Teori Atom Dalton
·
Atom adalah
partikel yang tidak dapat dibagi lagi menjadi bagian yang lebih kecil dan
bersifat masif (pejal),
·
Atom-atom
dari unsur sejenis mempunyai sifat yang sama.
·
Atom-atom
dapat bergabung membentuk molekul.
·
Kelemahan model
atom ini tidak menyinggung tentang kelistrikan.
Teori Atom Thomson
·
Atom teridiri
dari partikel yang bermuatan listrik positif dan negatif yang jumlahnya sama
melekat pada permukaan seperti kismis melekat pada roti.
·
Atom adalah
masif, karena partikel-partikel pembentuk atom tersebar merata.
Teori Atom Rutherford
·
Atom terdiri
atas:
1. Inti atom bermuatan positif dan massa atom hampir
seluruhnya terkumpul pada inti.
2. Elektron yang bermuatan listrik negatif bergerak
mengelilingi inti seperti lintasan tata surya (planet-planet mengelilingi
matahari).
3. Sebagian besar dari atom adalah ruang hampa.
4. Jumlah muatan inti = jumlah muatan elektron yang
mengelilingi.
5. Gaya sentripetal elektron selama mengelilingi inti
dibentuk oleh gaya coulomb.
Contoh atom hidrogen.
Kelemahan model atom Rutherford:
1.
Elektron yang
mengelilingi inti akan terus memancarkan energi berupa gelombang elektromagnet
sehingga lintasannya berbentuk spiral dan suatu saat jatuh kedalam inti.
2.
Tidak dapat
menerangkan struktur stabil untuk atom.
3.
Tidak dapat menerangkan
spektrum atom gas hidrogen.
Teori Atom Bohr
·
Pada dasarnya
teori atom bohr sama denga teori atom Rutherford dengan ditambah teori kuantum
untuk menyempurnakan kelemahannya.
·
Teori atom
Bohr didasarkan pada dua postulat, yaitu:
Postulat 1:
Elektron-elektron yang mengelilingi inti mempunyai lintasan tertentu yang
disebut lintasan stasioner dan tidak memancarkan energi. Dalam gerakannya
elektron mempunyai momentum anguler sebesar:
Postulat 2:
·
Dalam tiap
lintasannya elektron mempunyai tingkat energi tertentu 9makin dekat dengan inti
tingkat energinya makin kecil dan tingkat energi paling kecil n = 1).
·
Bila elektron
pindah dari kulit luar ke dalam maka akan memancarkan energi berupa foton. Sebaliknya
bila pindah dari kulit dalam ke luar akan menyerap energi.
Jari-jari Lintasan
Dari postulat 1 teori atom
Bohr, dapat ditentukan besar jari-jari lintasannya yaitu:
Energi dan Panjang Gelombang
Dari postulat 2 dapat
ditentukan besar energi yang dipancarkan dan panjang gelombang nya,yaitu:
Spektrum Atom Hidrogen
Pancaran energi yang terjadi
akibat dari perpindahan lintasan elektron dapat menghasilkan spektrum garis
pada atom hidrogen yang teridiri dari:
Soal dan Penyelesaian
1. Berapa besar kecepatan elektron pada atom hidrogen jika
jari-jari lintasannya adalah 0,1 nm?dan hitung juga jari-jari lintasannya
bilangan kuantum 3!
2. Hitung panjang gelombang terbesar dan terkecil dari deret
Paschen!
3. Berapa besar energi yang dipancarkan oleh atom hidrogen
bila elektron pindah dari bilangan kuantum 3 ke 2? Energi tingkat dasarnya = -13,6 Ev?








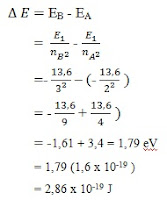


0 comments:
Post a Comment